ENTROPIA
Cosa significa entropia? L'entropia misura la quantità di energia non più disponibile in un sistema chiuso e isolato. Questo concetto ha diverse implicazioni sulle politiche energetiche e in ecologia. Per capire bene il significato di entropia occorre ricordare i due principi o leggi della termodinamica.
Il primo principio della termodinamica
Secondo la prima legge della termodinamica, nulla si crea, nulla si distrugge e tutto si trasforma. Quando l'acqua cambia il suo stato fisico da liquido a solido ( ghiaccio ) o gassoso ( vapore acqueo ) o viceversa, non muta la quantità delle molecole H2O. È sempre la stessa dopo ogni trasformazione.
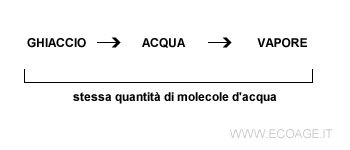
Questo potrebbe indurre a pensare che in un sistema chiuso la quantità di energia è costante ed è recuperabile in eterno. In realtà, non è così. Tutto si trasforma ma non tutte trasformazioni sono reversibili. Alcune sono irreversibili. Ad esempio, il mutamento dello stato fisico dell'acqua è reversibile. Molte reazioni chimiche, invece, non sono reversibili ( es. combustione ). Per capirlo bisogna studiare anche il secondo principio della termodinamica.
Il secondo principio della termodinamica ( entropia )
In base al secondo principio della termodinamica, nel corso del tempo un sistema chiuso tende verso un equilibrio di alta entropia, in cui la quantità di energia non più disponibile è massima. Si tratta di un processo irreversibile.
Un esempio pratico
Quando si brucia un pezzo di carbone, la combustione converte la materia in calore, energia lavoro, scorie solide ( cenere ) ed emissioni di carbonio nell'aria ( fumo, gas ). La conversione in energia e calore è irreversibile. Anche se recuperassimo tutto il calore, le ceneri e i gas, non potremmo ricombinarle tra loro per ricreare il carbone.
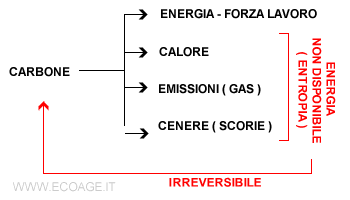
La combustione ha aumentato l'energia non disponibile nel sistema, facendolo passare da una situazione iniziale di bassa entropia a una finale di alta entropia.
Inoltre, ogni ulteriore conversione degrada e disperde una parte della materia nell'ambiente in modo irreversibile ( es. polverizzazione ). Pertanto, dopo ogni ciclo di trasformazione il sistema perde un po' di energia disponibile.
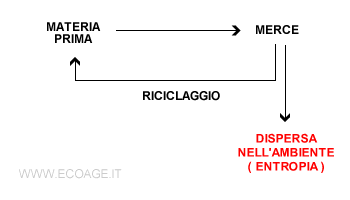
Ad esempio, il riciclaggio consente di riusare le materie prime contenute nei rifiuti ( es. metalli, vetro, ecc. ) per produrre nuove merci. Tuttavia, il riciclaggio non recupera il 100% dei materiali. Quando si taglia o si lavora un materiale una parte viene polverizzata e non è recuperabile. Una parte della materia si disperde o si polverizza irreversibilmente nell'ambiente e non è più riciclabile.
In conclusione, l'entropia è un limite alla trasformazione della materia. Tutti i sistemi chiusi passano da uno stato a bassa entropia a uno stato finale ad alta entropia detto morte termica. Questo vale sia per una macchina termica, che per il pianeta Terra o per l'intero Universo.
La storia dell'entropia
Il primo a intuire l'entropia fu il fisico Rudolf Clausius nel 1868. Si accorse che tutti i sistemi isolati tengono a raggiungere un equilibrio termico. Gli studi furono ripresi da Carnot agli inizi del XX secolo, a cui si deve la seconda legge della termodinamica ( ossia l'entropia ). Sadi Carnot approfondì il funzionamento delle macchine termiche. Osservò lo spostamento del calore dalle zone più calde a quelle più fredde all'interno di una macchina termica.
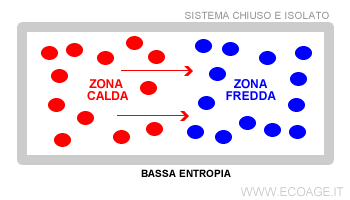
Lo spostamento del calore produce energia ( forza lavoro ). Quanto più alto è il differenziale energetico nel sistema chiuso e limitato, tanto maggiore è l'energia disponibile da sfruttare per generare forza lavoro. Il sistema chiuso non ha scambi con l'esterno. Pertanto, il differenziale è destinato a ridursi nel tempo fino a raggiungere un equilibrio finale.
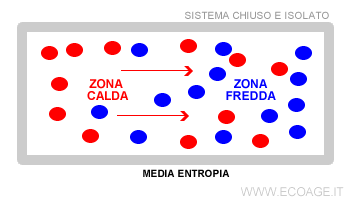
Quando la macchina torna in equilibrio la temperatura è costante in ogni parte del sistema. In condizioni di equilibrio cessa ogni spostamento del calore. Quindi, il sistema ha erogato tutta l'energia ossia ha raggiunto la massima entropia. Questa condizione finale è detta morte termica perché è permanente e irreversibile in un sistema chiuso.

Il limite come paradigma scientifico e tecnologico
Il concetto fisico di entropia è stato utilizzato nella seconda metà del XX secolo per costruire un nuovo paradigma scientifico, tecnologico ed economico. Ha consentito di introdurre un limite alla crescita produttiva, fino a quel momento considerata infinita e illimitata.
Il pianeta Terra è sottoposto alle leggi del processo entropico. Lo sfruttamento intensivo delle risorse naturali esauribili ( es. risorse fossili, minerali, gas, petrolio, carbone, ecc. ) ne causa l'esaurimento in modo irreversibile. Pertanto, la quantità di energia non disponibile aumenterà progressivamente fino a raggiungere lo stadio finale di massima entropia ( morte termica ). L'irreversibilità del processo è inevitabile.

L'uomo può rallentare il processo entropico del pianeta adottando lo sviluppo sostenibile, l'uso delle risorse rinnovabili e il riciclaggio, la tutela ambientale, ma non può fermarlo del tutto. Lo stessa sorte riguarda il sistema solare e l'intero Universo. La morte termica è una delle ipotesi astrofisiche più accreditate sulla morte del cosmo ( Big Freeze ). In conclusione, il limite è una realtà con cui l'uomo deve imparare a convivere.